១.១. ប្រតិកម្មរហ័ស
ប្រតិកម្មរហ័ស គឺជាប្រតិកម្មដែលប្រព្រឹត្តទៅក្នុងរយៈពេលដ៏ខ្លីមួយ។
ឧទាហរណ៍ៈ
-
`Ag (aq) + CI (aq) →AgCl(s)`
-
`Cu^2+(aq) + OH (aq)→ Cu(OH)(s)`
ស៊ីនេទិចគីមីគឺជាការសិក្សាអំពីបម្រែបម្រួលល្បឿនប្រតិកម្ម។
ប្រតិកម្មរហ័ស គឺជាប្រតិកម្មដែលប្រព្រឹត្តទៅក្នុងរយៈពេលដ៏ខ្លីមួយ។
ឧទាហរណ៍ៈ
`Ag (aq) + CI (aq) →AgCl(s)`
`Cu^2+(aq) + OH (aq)→ Cu(OH)(s)`
ប្រតិកម្មយឺត គឺជាប្រតិកម្មដែលប្រព្រឹត្តទៅច្រើនវិនាទី នាទី ឬច្រើនម៉ោង។
ឧទាហរណ៍ៈ ឌីស្មូតកម្មអ៊ីយ៉ុងត្យូស៊ុលផាត `S_2O_3^2` ក្នុងមជ្ឈដ្ឋានអាស៊ីត ឲ្យផលជា `S`និង `SO_2` ។
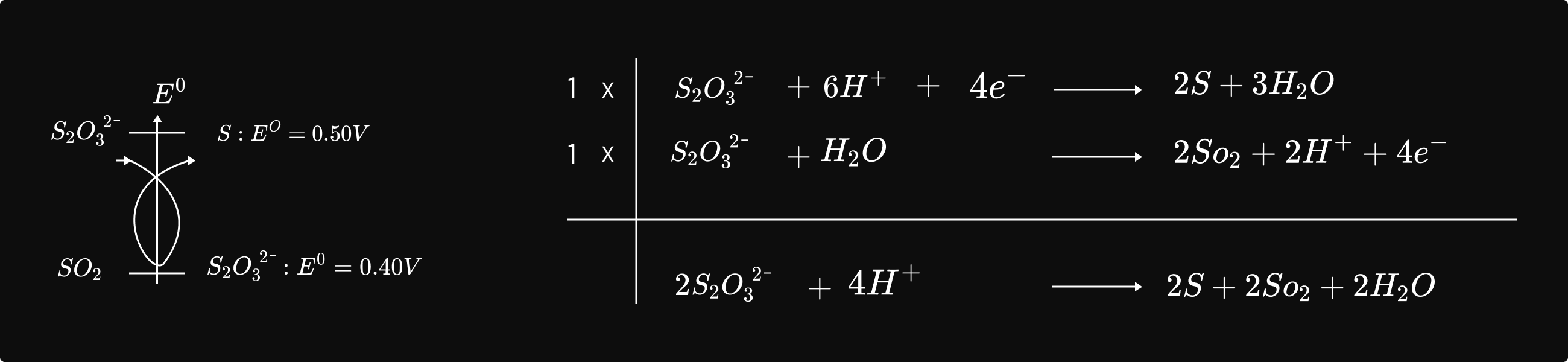
ជាទូទៅប្រតិកម្មយឺតជាកម្មវត្ថុក្នុងការសិក្សាស៊ីនេទិច
ប្រតិកម្មយឺតបំផុតគឺជាប្រតិកម្មដែលប្រព្រឹត្តទៅច្រើនថ្ងៃ ច្រើនខែ ឬច្រើនឆ្នាំ។
ឧទាហរណ៍៖ ប្រតិកម្មបំបែកទឹកអុកស៊ីសែន `H_2O_2`
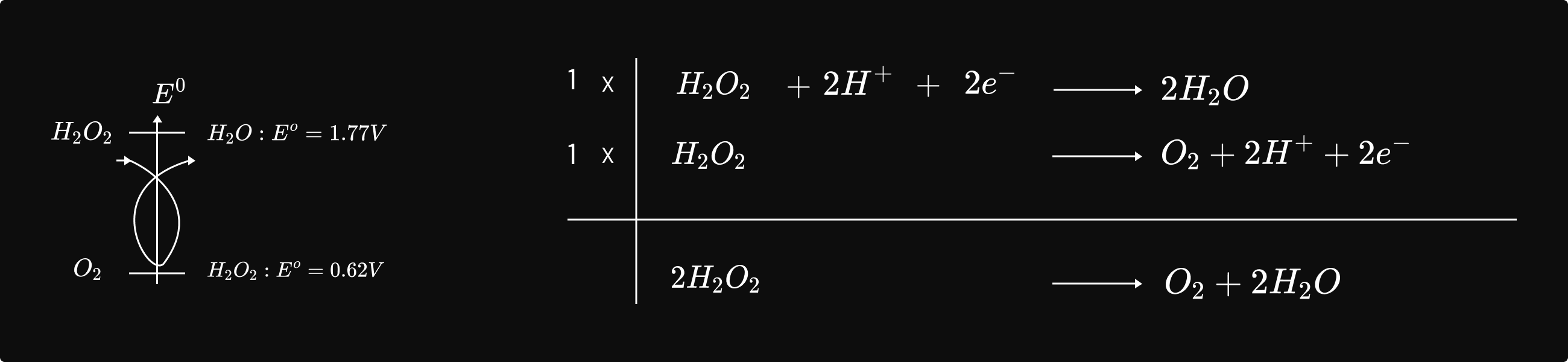
ក. សិក្សាពិសោធន៍
គេលាយសូលុយស្យុង `H_2O_2` ជាមួយសូលុយស្យុង `KI` គេឃើញសូលុយស្យុងប្រែជា ព៌ណក្រហមត្នោតដោយសារកកើត `I_2` ។
យើងបានរូបមន្ត៖
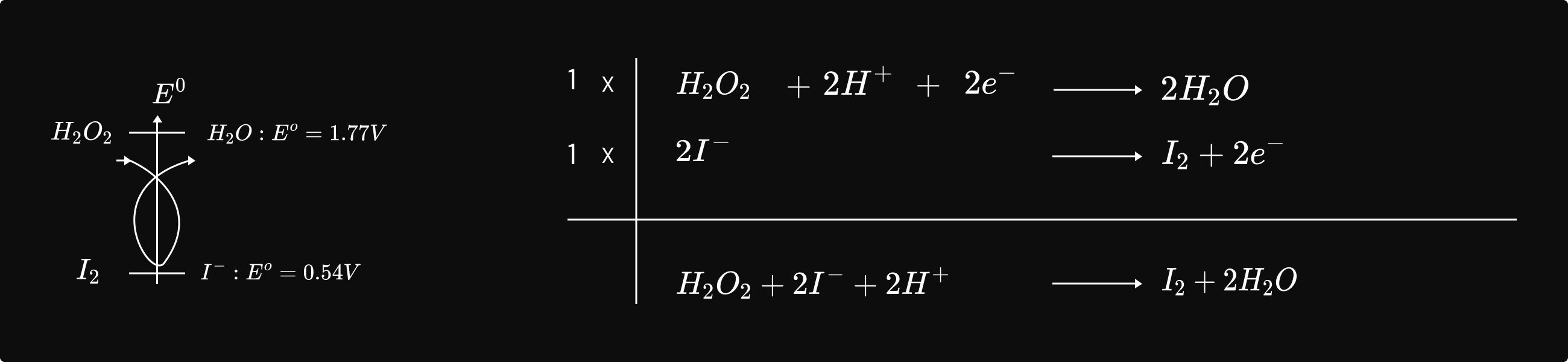
និយមន័យ : ល្បឿនមធ្យមនៃកំណ `I_2` នៅចន្លោះពេល t1 ទៅ t2 គឺជាផលធៀបរវាងបម្រែបម្រួលកំហាប់ `I_2` ជាមួយបម្រែបម្រួលរយៈពេល t ។
ខ. លឿបមធ្យាយកំណ `I_2`
និយមន័យ : ល្បឿនមធ្យនៃកំលា `I_2` នៅចន្លោះពេលT1 ទៅT2គឺជាផលធៀបរវាងបម្រែបម្រួលកំហាប់T2 ជាមួយបម្រែបម្រួល រយៈពេលT យើងបានរូបមន្ត៖` V_m=frac{[I_2]_2-[I_2]_1}(t_2-t_1)=frac{Delta[I_2]}(Delta t)`
បកស្រាយតាមក្រោប ល្បឿនមធ្យមនែកំណ T2 នៅចន្លោះពេលT1ទៅt2មានតម្លែស្មើនឺងមេគុណប្រាប់ទិសនៃបន្ទាប់កាត់`M_1`,និង `M_2`
បកស្រាយតាមក្រាប៖ ល្បឿនមធ្យមនៃកំណ `I_2`នៅចន្លោះពេល t1ទៅ t2 មានតម្លៃស្មើនឹង មេគុណប្រាប់ទិសនៃបន្ទាប់កាត់ `M_1`,និង `M_2` គេលាយសូយស្យុង `H_2O_2` ជាមួយសូសុយស្យុង គេឃើញៃូសុយស្យុង ប្រែងជាព៏ណក្រហមត្នោត ដោយ សារករាកើត។
យើងបានរូបមន្ត៖ `V_m=frac{[HM_2]}([HM_1])=frac{[DeltaI_2]}(Delta t)V_m=frac{|HM_2|}(|HM_1|)=frac{Delta[I_2]}(Delta t)`
គ. ល្បឿនខណៈកំណ I2
និយមន័យ៖ ល្បឿនខណៈនៃកំណ `I_2` នៅខណៈពេល `t` គឺជាលីមីត នៃល្បឿនមធ្យម កាលណាបម្រែបម្រួលរយៈពេលខិតទៅរកសូន្យ។
រូបមន្ត `V_t=lim frac{[I_2]}(I_2 - I_1) = V_(Delta t → 0) frac{Delta[I_2]}(Delta t)`ឬ `V_t =( frac{d[I_2]}(Delta t))t`
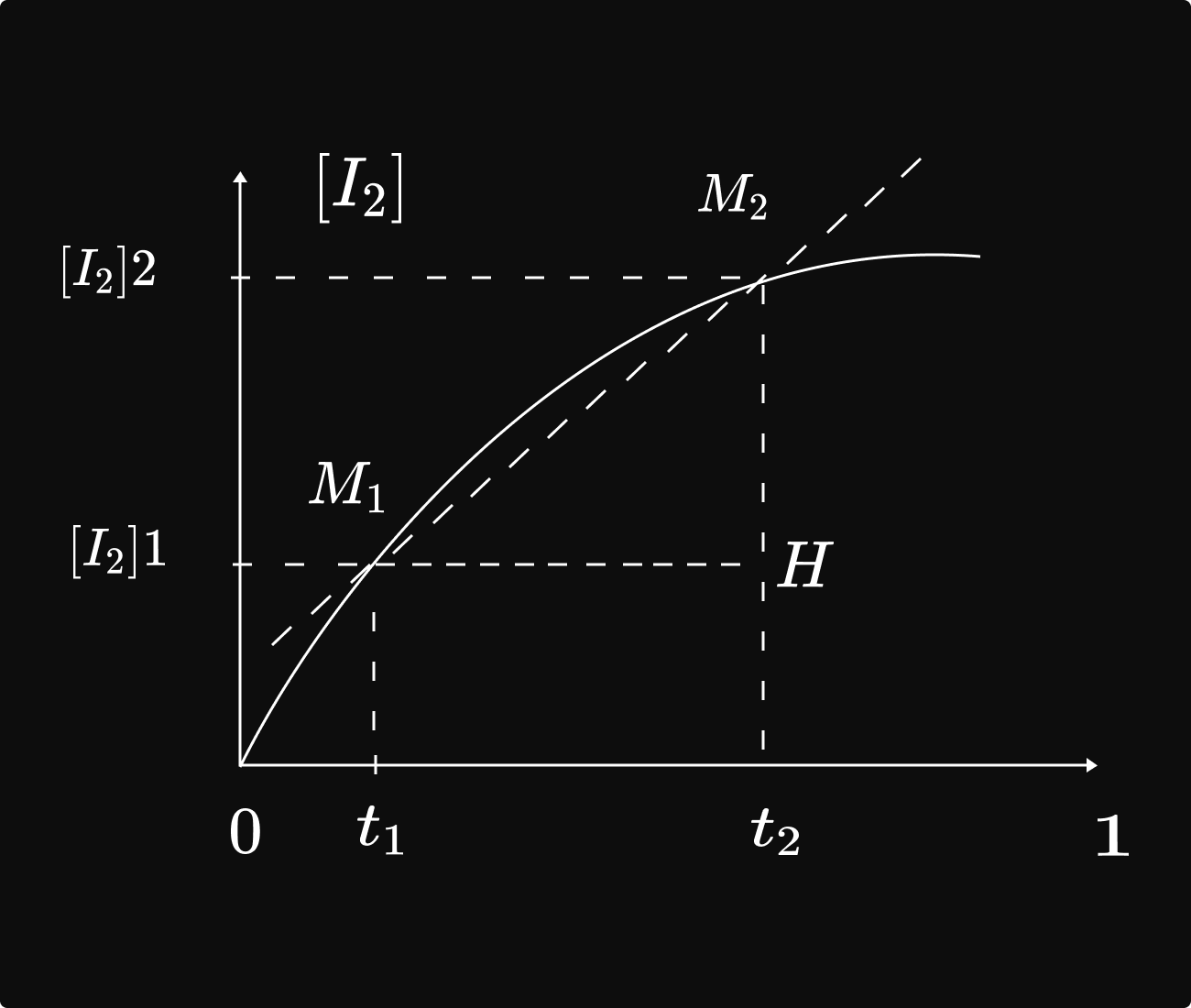
បំណកស្រាយតាមក្រាប ៖ ល្បឿនខណៈ នៃកំណ មានតម្លៃស្មើនឹងមេគុណប្រាប់ទិស នៃបន្ទាត់ប៉ះខ្សែកោងត្រង់ចំណុច `M` និងអាប់ស៊ីស `t` ។ `V_t = frac{[HI_2]}([HI_2]) = frac{Delta[T_2]}(Delta t) `
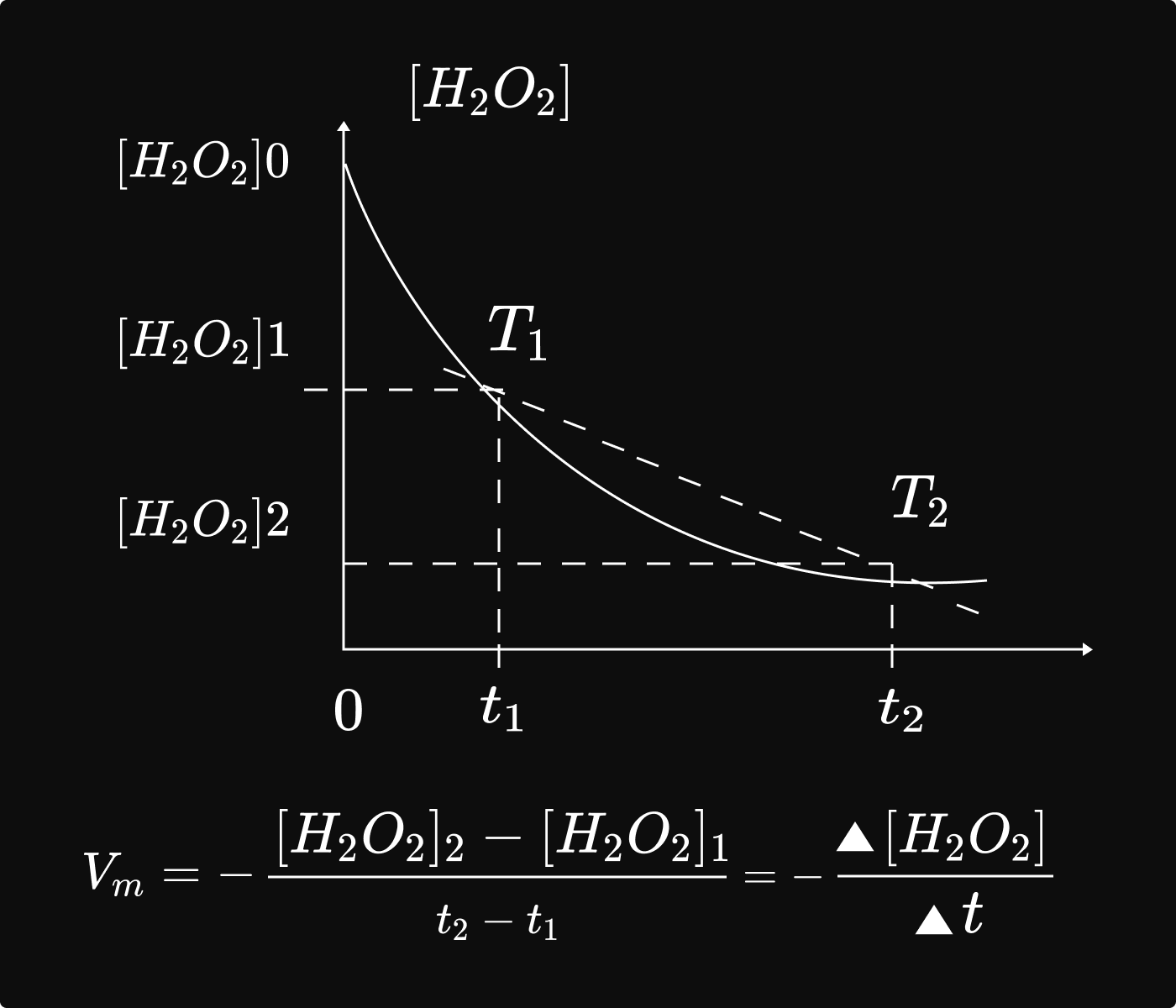
ក. ល្បឿនមធ្យមបំបាត់ ` H_2O_2 `
និយមន័យ៖ ល្បឿនមធ្យមបំបាត់ H2O2នៅចន្លោះពេល `t_1` ទៅ `t_2` គឺជាផលធៀបរវាងបម្រែបម្រួល កំហាប់ `H_2O_2`ជាមួយនឹងបម្រែបម្រួលរយៈពេល t
យើងបានរូបមន្ត `V_m=frac{[H_2O_2]_2- [H_2O_2]_1}(t_2- t_1) =frac{Delta[H_2O_2]}(Delta t) `

ខ. ល្បឿនខណៈបំបាត់ H2O2
និយមន័យ៖ ល្បឿនខណៈបំបាត់ `H_2O_2` នៅ ខណៈពេល `t` គឺជាលីមីតនៃល្បឿនមធ្យមកាលណាបម្រែបម្រួលរយៈពេលខិតទៅរកសូន្យ។
យើងបានរូបមន្ត ៖ `V_t=lim_(Delta t to 0) - frac{[H_2O_2]_2- [H_2O_2]_1}(t_2- t_1) lim_(Delta t to 0 )- frac{Delta[H_2O_2]}(Delta t)` ឬ `V_t =( frac{d[H_2O_2]_2}dt)t`
ជាទូទៅ៖ កំហាប់គិតជា `mol.L^(-1)` រយៈពេលគិតជា `min` ឬ `s` និងល្បឿនគិតជា `mol.L^(-1)min^(-1)` ឬ `mol.L^(-1)S^(-1)` ។

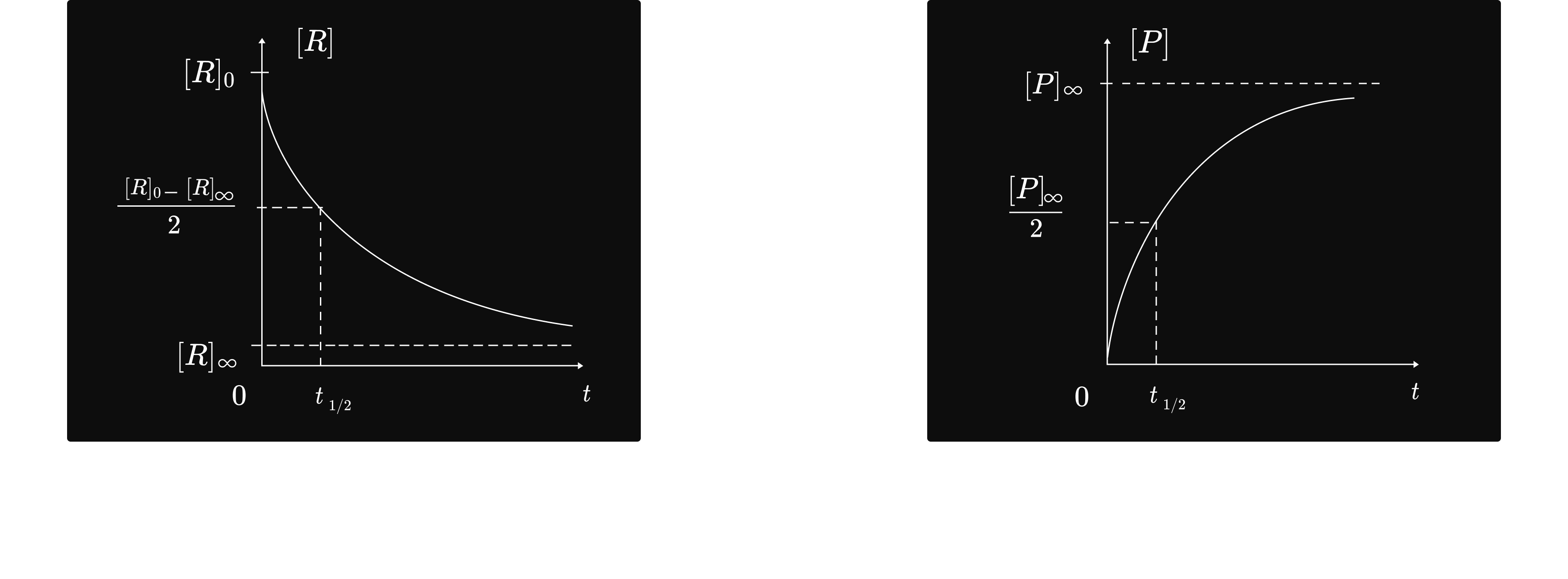
កំហាប់អង្គធាតុប្រតិករថយចុះជាអនុគមន៍ទៅនឹងរយៈពេល ហើយនៅពេលអានន្ត កំហាប់អង្គធាតុប្រតិករវិវត្តទៅរកកំហាប់អានន្តដែរ `[R]_infty `។
កំហាប់អង្គធាតុកកើតកើនឡើងជាអនុគមន៍ទៅនឹងកំណើនរយៈពេល ហើយនៅពេល អានន្ត កំហាប់អង្គធាតុកកើតវិវត្តទៅរកកំហាប់អានន្តដែរ `[P]_infty `។
ជាទូទៅ៖ ក្នុងពេលប្រតិកម្ម កំហាប់អង្គធាតុប្រតិករថយចុះ ឯកំហាប់អង្គធាតុកកើតកើនឡើង។
ពេលពាក់កណ្តាលប្រតិកម្ម `frac{t_1}2` គឺជាពេលដែលត្រូវនឹងកំហាប់ផលិតផល កកើតបានពាក់ កណ្តាល ឬ កំហាប់អង្គធាតុប្រតិករអស់ពាក់កណ្តាល។
កំហាប់ផលិតផលកកើតបានពាក់កណ្តាល `[P]t½ = frac{[P]_infty}2`
កំហាប់អង្គធាតុប្រតិករនៅសល់ពាក់កណ្តាល
`[R]_(tfrac{1}2) = frac{[P]_0 -[R]_infty}2`
ល្បឿនបំបាត់អង្គធាតុប្រតិករថយចុះ ជាអនុគមន៍ទៅនឹងកំណើនរយៈពេល ហើយខ្សែ កោង
`[R] = f(t)`ខិតជិតអាស៊ីមតូតដេក `[R]_infty ` ។
ល្បឿនកំណអង្គធាតុកកើតថយចុះ ជាអនុគមន៍ ទៅនឹងកំណើនរយៈពេល ហើយនៅ ពេលអានន្តខ្សែកោង `[P] = f(t)` ខិតជិតអាស៊ីមតូតដេក`[P]_infty ` ។
ពិសោធន៍៖គេដាក់ដុំ `CaCO_3` ទំហំធំល្មមចំនួន 20g, ដុំ `CaCO_3` តូចៗ20g និងម្សៅ `CaCO_3` 20g ទៅក្នុងសូលុយស្យុង `HCl` ក្នុងកែវបីផ្សេងគ្នាតាមរៀង ដែលកែវនីមួយៗមានកំហាប់ 1 M មាឌ 200 mL ។
សង្កេត៖ ប្រតិកម្មដោយប្រើម្សៅ `CaCO_3` ជាមួយ `HCl` លឿនជាងប្រើដុំតូចៗ និងលឿនជាដុំធំ តាមរៀង។ សន្និដ្ឋាន៖ ល្បឿនប្រិតកម្មអាស្រ័យលើទំហំភាគល្អិត។ ទំហំភាគល្អិតនៃអង្គធាតុប្រតិករ កាន់ តែតូច ល្បឿនប្រតិកម្មកាន់តែលឿន។ បកស្រាយ៖ កាលណាទំហំភាគល្អិតកាន់តែតូច នាំឲ្យមានការទង្គិចប្រសិទ្ធ រវាងអង្គធាតុប្រតិករ កាន់តែច្រើន ជាហេតុធ្វើឲ្យល្បឿនប្រតិកម្មកាន់តែលឿន។
សន្និដ្ឋាន៖ ល្បឿនប្រិតកម្មអាស្រ័យលើទំហំភាគល្អិត។ ទំហំភាគល្អិតនៃអង្គធាតុប្រតិករ កាន់ តែតូច ល្បឿនប្រតិកម្មកាន់តែលឿន។
បកស្រាយ៖ កាលណាទំហំភាគល្អិតកាន់តែតូច នាំឲ្យមានការទង្គិចប្រសិទ្ធ រវាងអង្គធាតុប្រតិករ កាន់តែច្រើន ជាហេតុធ្វើឲ្យល្បឿនប្រតិកម្មកាន់តែលឿន។
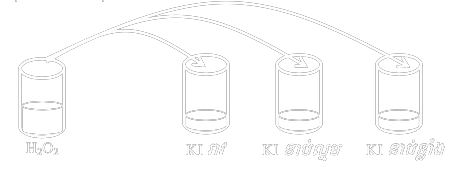
ពិសោធន៍៖ រៀបចំកែវបីដាក់សូលុយស្យុង `KI` ដែលមានកំហាប់ខុសៗគ្នា ដោយមានបន្ថែម សូលុយស្យុង `H_2O_3` បន្តិច។ បន្ទាប់មកចាក់ `H_2SO_4` ក្នុងបរិមាណស្មើគ្នា កំហាប់ស្មើគ្ន ចូលក្នុងកែវទាំងបីក្នុងពេលតែមួយ។
សមីការ៖ `H_2O_3+ 2I^- + 2H^+ → ] + 2H_2O`
សង្កេត៖ កែវដែលមានកំហាប់ `KI` ខាប់ខ្លាំង ( `I^-`ច្រើន ) នោះការឡើងពណ៌ក្រហមត្នោតនៃ `I^2`លឿនជាង កែវដែលមានកំហាប់ `KI` រាវ ឬ `I^-` តិច។
សន្និដ្ឋាន៖ ល្បឿនកំណអង្គធាតុកកើត ឬល្បឿនបំបាត់អង្គធាតុប្រតិករ កើនកាលណា កំហាប់អង្គធាតុប្រតិករកើនឡើង។
បំណកស្រាយ៖ កំហាប់អង្គធាតុប្រតិករកើន នាំឲ្យមានទង្គិចប្រសិទ្ធច្រើន ដូចនេះល្បឿនបំបាត់ ឬល្បឿនកំណក៏កើនឡើងដែរ។
សម្ពាធមានឥទ្ធិពលតទៅលើប្រព័ន្ធប្រតិកម្មដែលមានភាពរូបជាឧស្ម័នតែប៉ុណ្ណោះ។ កាលណាសម្ពាធកើនឡើង នាំឲ្យចំនួនទង្គិចប្រសិទ្ធកើនឡើងដែរនោះល្បឿនប្រតិកម្មកើនឡើង។
ឧទា. ទង្វើអាម៉ូញាក់តាមលំនាំហេប៊ើត្រូវការសីតុណ្ហភាព និងសម្ពាធខ្ពស់ចំពោះមុខកាតាលីករដែក។
សន្និដ្ឋាន៖ កាលណាសម្ពាធកើន នាំឲ្យការកកើតអាម៉ូញាក់ក៏កើនដែរ។
បំណកស្រាយ៖ កាលណាសម្ពាធកើន នាំឲ្យម៉ូលេគុលឧស្ម័ននៅកៀកគ្នា ជាហេតុធ្វើឲ្យមានទង្គិច ប្រសិទ្ធកើនឡើង។ ដូចនេះល្បឿនកំណអង្គធាតុកកើត កើនឡើង។
ពិសោធន៍៖ បំពង់សាកពីរ `A` និង `B` ដាក់សូលុយស្យុង `I^-` ប្រហែល `½` នៃបំពង់សាកដោយមាន លាយសូលុយស្យុង `H_2SO_4`បន្តិច។ បន្ទាប់មក យកបំពង់សាក `A` ដាក់ត្រាំក្នុង និងបំពង់សាក `B` ត្រាំក្នុងទឹកក្តៅ។ ចាក់សូលុយស្យុង `H_2SO_4` ប្រហែល `½ O` ដែរ ទៅក្នុង បំពង់ សាកទាំងពីរខាងលើក្នុងពេលដំណាលគ្នា។

សង្កេត៖ ចូរកំណត់កម្លាំងអន្តរម៉ូលេគុលនិងសម្ព័ន្ធអុីដ្រូសែ នៃគូក្នុងសមាសធាតុខាងក្រោម៖
បកស្រាយ៖ នៅពេលសីតុណ្ហភាពកើន ភាគល្អិត (ម៉ូលេគុល អាតូម ឬ អុីយ៉ុង) ធ្វើចលនាកាន់ តែលឿន នាំឲ្យមានទង្គិចប្រសិទ្ធកាន់តែច្រើន។ដូចនេះ ល្បឿននៃប្រតិកម្មកាន់តែលឿនដែរ។
ពិសោធន៍៖ គេមានបំពង់សាកពីរ `A` និង `B` ដែលមានដាក់ `H_2O_3` ប្រហែល 1 នៃបំពង់សាកនោះ។ គេពុំឃើញមានបាតុភូតអ្វីកើតឡើងទេ។ ប៉ុន្តែប្រសិនបើគេបន្ថែមបរិមាណបន្តិចនៃ `MnO_2`ចូលក្នុង បំពង់សាក` A` ។

សង្កេត ៖ វត្តមាន `MnO2` ក្នុងបំពង់សាក `A` គេឃើញមានពពុះឧស្ម័នកើតឡើង
និងអាចធ្វើឲ្យរងើកភ្លើងធូបឆេះច្រាល។
គ្មានវត្តមាន `MnO_2` ក្នុងបំពង់សាក `B` គេគ្មានឃើញបាតុភូតអ្វីកើតឡើង។
សន្និដ្ឋាន ៖ `MnO_2` ជាកាតាលីករ។ ដូចនេះកាតាលីករ គឺជាសារធាតុដែលធ្វើឱ្យប្រតិកម្មកើត ឡើងកាន់តែលឿន។
បកស្រាយ៖ វត្តមាន `MnO_2` ក្នុង `H_2O_2` (បំពង់សាក`A`) បានជួយបំបែកជាឧស្ម័នអុកស៊ីសែន និងទឹក ដោយ `H_2O_3` រក្សាបរិមាណនៅដដែល។
* កាតាលីករ គឺជាសារធាតុដែលជួយពន្លឿនល្បឿនប្រតិកម្មគីមីកើតឯង ហើយវាកើតឡើង វិញដោយគ្មានបាត់បង់លក្ខណៈគីមីនៅពេលប្រតិកម្មចប់។
កាតាលីស គឺជាអំពីនៃកាតាលីករទៅលើប្រតិកម្មគីមី។
គេចែកកាតាលីសជាបីប្រភេទ៖
កាតាលីសអូម៉ូសែន ៖ គឺជាកាតាលីសដែលកាតាលីករ និងអង្គធាតុប្រតិករមានផាសដូចគ្នា។
ឧទា `H_2O_3(ag) →^(fe^(2+(ag))) H_2O (l)+ ½O_2( g) `
អង្គធាតុប្រតិករជាសូលុយស្យុង ឯកាតាលីករក៏ជាសូលុយស្យុងដែរ។
កាតាលីសអេតរ៉ូសែន ៖ ជាកាតាលីសដែលកាតាលីករនិងអង្គធាតុប្រតិករមានផាសខុសគ្នា។
ឧទា `H_2O_3(ag) →^(MnO_2 (g)) H_2O (l)+ ½O_2( g) `
អង្គធាតុប្រតិករជាសូលុយស្យុង ឯកាតាលីករក៏ជាអង្គធាតុរឹង។
ឧទ. `H_2O_2(aq) → H_2O(l) + 1⁄2 O2(g)`
នាទីលើស៊ីនេទិច
កាតាលីករអាចបង្កើនល្បឿនតែទៅលើប្រតិកម្មទាំងឡាយណាដែលប្រព្រឹត្តទៅតាមទែម៉ូឌីណាមិចប៉ុណ្ណោះ។ ចំពោះប្រតិកម្មដែលមានភាពរាំងខ្ទប់ស៊ីនេទិច គ្មានកាតាលីករណាអាចធ្វើ ឲ្យប្រតិកម្មប្រព្រឹត្តទៅបានទេ។
ឧទា. `Cu(s) + HCl(aq) →` គ្មានប្រតិកម្មកើតឡើងទេ
បាតុភូតវិសេសភាព
កាលណាកាតាលីករមួយមានសកម្មភាពលើប្រតិកម្មគីមីមួយច្បាស់លាស់គេនិយាយថា កាតាលីករមានវិសេសភាពចំពោះប្រតិកម្មនោះ។
ឧទា. ដេស៊ីដ្រូសែនកម្មអេតាណុល
`CH_2CH_2OH ( ag ) to^(Cu) CH_3OH ( ag ) + H_2 ( g )`
`CH_2CH_2OH ( ag )to^(Al_2O_3( 400^oC )) CH_2=CH_2+H_2 O ( g )`
កាតាលីករ ជាទូទៅគេប្រើក្នុងបរិមាណតិច
ឧទា. ប្រតិកម្មផលិតអាម៉ូញាក់ដោយសំឡីដែក។ គេអាចប្រើសំឡីដែកក្នុងបរិមាណតិច ធៀបនឹងបរិមាណអង្គធាតុប្រតិករ និងប្រើក្នុងរយៈពេលយូរអង្វែងមិនងាយដូរ។
កាតាលីករចូលរួមប្រតិកម្ម
ឧទា. ប្រតិកម្មឌីស្មូតកម្ម H2O2 ដោយប្រើ កាតាលីករ Fe2+។

* ដូចនេះអុីយ៉ុង `Fe+` ចូលរួមប្រតិកម្ម តែក្រោយប្រតិកម្មចប់ វាកកើតឡើងវិញដដែល។
និយមន័យ៖ ស្វ័យកាតាលីសគឺជាកាតាលីសដែលអង្គធាតុកកើតមាននាទីជាកាលីករក្នុងប្រតិកម្ម។
ឧទា. រេដុកម្មអីយ៉ុងពែម៉ង់កាណាត `MnO_4^-`ដោយអាស៊ីតអុកសាលិច `H_2C_2O_4`

ម៉ឺយ៉ុង `Mn2^+ `មានតួនាទីជាកាតាលីករក្នុងប្រតិកម្មខាងលើ។
កាតាលីសមានសារៈសំខាន់យ៉ាងខ្លាំងចំពោះឧស្សាហកម្មគីមី
ចំណេញពេលវេលា ថវិកា
បង្កើនផលិតផល និង
សម្រាំងផលិតផល
សមាសធាតុភាគច្រើនរលាយក្នុងទឹកបំបែកជាអីយ៉ុង ។
ឧទា.
`NaClS to ^ (H_2O) Na^+(ag) +Cl^- + (ag)`
`Ca(2NO_3)_2 (s) to ^(H_2O) Ca^(2+) (ag) + 2NO^(3-) (ag) `
`HCl (g) + H_2O (l) to H_2O^(+) (ag) + Cl^(-)ag `<< /p>/li>
សមាសធាតុអ៊ីយ៉ុងមួយចំនួនមិនរលាយក្នុងទឹកទេ។
សមាសធាតុរលាយឬមិនរលាយក្នុងទឹកមានបង្ហាញក្នុងតារាងធាតុរលាយ ។
ឧទា.
` AgNO_3(aq) + NaCl (aq) → AgCl (s) + NaNO_3 (aq) `
`2NaOH(aq) + CuSO_4(aq) → Cu(OH)_2(s) + Na_2SO_4(aq)`
សមីការអ៊ីយ៉ុងសម្រួលជាសមីការដែលសរសេរតែប្រភេទគីមីទាំងឡាយណា ដែលរងនូវបម្រែបម្រួលគីមីក្នុងលំនាំប្រតិកម្ម។
ឧទា.
`AgNO_3(aq) + NaCl (aq) → AgCl(s) + NaCl (aq)` (សមីការម៉ូលេគុល)
`Ag^+(aq) + NSO_3^- (aq) + Na^+(aq) + Cl^+ (aq) → AgCl (s) + NA^+(aq) + CI^- (aq)`
អីយ៉ុងកម្ម ជាលំនាំបំបែកជាអ៊ីយ៉ុងនៃសារធាតុរលាយដោយអំពើនៃសារធាតុរំលាយ។ កាលណា សមាសធាតុអ៊ីយ៉ុងរលាយ អីយ៉ុងត្រូវបានផ្ដាច់ចេញពីគ្នា ហើយត្រូវហ៊ុំព័ទ្ធដោយ ម៉ូលេគុលសារធាតុរំលាយ(ឧទា. ទឹក) ។
ឧទា.
`NaCl (s) → Na (aq) + CI^- (aq)`
`HCI (g) + H_2O(l) H_3O^+ + (aq) + CI^- (aq)`
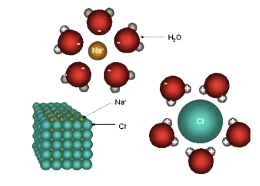
ទឹកចាប់យកអុីយ៉ុង`H^+`(ប្រូតុង( ពីអាស៊ីត បង្កើតបានជាអ៊ីយ៉ុងអ៊ីដ្រូញ៉ូម `( H_3O^+ )`))។
`Ba(OH)_2(S) to^(H_2O) H^+ (ag) + Cl^- (ag)` (l)
`H^+ (ag) + H_2O (l) to H_2O^+ (ag)` (2)
ជាសរុប `HCl (g) + H_2O(l) to H_3O^+(ag)+Cl^- (ag)`
សារធាតុឲ្យផលជាអុីយ៉ុងនិងចម្លងចរន្តអគ្គិសនីក្នុងសូលុយស្យុងទឹក ជាអេឡិចត្រូលីត។
សារធាតុមិនឲ្យផលជាអុីយ៉ុង និងមិនចម្លងចរន្តអគ្គិសនី
ក្នុងសូលុយស្យុងទឹក មិនមែនជាអេឡិចត្រូលីតទេ ។
អេឡិចត្រូលីតខ្លាំងជាសារធាតុទាំងឡាយណាដែលបំបែកជាអ៊ីយ៉ុងទាំងស្រុងក្នុងទឹក។
ឧទា. បាសខ្លាំង អាស៊ីតខ្លាំង អំបិលរលាយសព្វក្នុងទឹក
`Ba(OH)_2 (s) to^(H_2) Ba^(2+) + 2OH^(-) (ag)`
`HCl(g) + H_2O^(+) (ag) + Cl^- (ag)`
`NaCl(s) to^(H_2O) Na^+(ag) + Cl^- (ag)`
អេឡិចត្រូលីតខ្សោយ ជាសារធាតុទាំងឡាយណាដែលបំបែកជាអុីយ៉ុងដោយផ្នែកក្នុងទឹក។
ឧទា. បាសខ្សោយ អាស៊ីតខ្សោយ14
`NH_3 (ag) + H_2O(l) to NH_4^+ + OH^- (ag)`
`CH_3COOH(ag) + H_2O(l) to H2O^+ (ag) + CH_3COO^- (ag)`
| សមាសធាតុអ៊ីយ៉ុង | សមាសធាតុកូវ៉ឡង់ |
|---|---|
|
|
សមាសធាតុអ៊ីយ៉ុងផ្សំឡើងពីអីយ៉ុងវិជ្ជមាននិងអវិជ្ជមាន។អីយ៉ុងដែលមានបន្ទុកផ្ទុយគ្នាប្រ ទាញគ្នាទៅវិញទៅមកបង្កើតបានជាកម្លាំងអ៊ីយ៉ុង (កម្លាំងអេឡិចត្រូស្តាទិច)។
អីយ៉ុងដែលមានទំហំតូចចូលផ្សំគ្នាបង្កើតជាសមាសធាតុមានចំណុចរំពុះខ្ពស់ជាង អីយ៉ុងដែលមានទំហំធំ។
ឧទា. `NaCl` មានចំណុចរំពុះខ្ពស់ជាង `KCl` ។
សមាសធាតុបង្កពីអីយ៉ុងដែលមានបន្ទុកធំមានចំណុចរំពុះខ្ពស់ជាងសមាសធាតុបង្កពីអីយ៉ុងដែលមានបន្ទុកតូច។
ឧទា. `CaCl` មានចំណុចរំពុះខ្ពស់ជាង `NaCl` ។
កម្លាំងប្រទាញគ្នាទៅវិញទៅមករវាងម៉ូលេគុលនិងម៉ូលេគុលហៅថា កម្លាំងអន្តរម៉ូលេគុល ។
កម្លាំងនេះអាចជាកម្លាំងឌីប៉ូល-ឌីប៉ូល និងកម្លាំងរបាយឡុនដុន ។
កម្លាំងទាំងពីរនេះអាចកើតមាននៅពេលវានៅជិតគ្នា។កម្លាំងនេះខ្សោយកាលណាម៉ូលេគុលនៅឆ្ងាពីគ្នា។ខ្លាំង ឬមានសីតុណ្ហភាពជិតតម្លៃសូន្យដាច់ខាត `(0 K = - 273 °C)` ។
ម៉ូលេគុលដែលមានចំណុចរំពុះខ្ពស់ជាង មានកម្លាំងអន្តរម៉ូលេគុលខ្លាំងជាង។
កម្លាំងរបាយឡុនដុនគឺ ជាកម្លាំងប្រទាញរវាងម៉ូលេគុល និងម៉ូលេគុលដែលមិនប៉ូល ។ ម៉ូលេគុលដែលមានម៉ាស់កាន់តែធំ ឬមានអេឡិចត្រុងកាន់តែច្រើន នោះមានកម្លាំង ប្រទាញរវាងម៉ូលេគុល និងម៉ូលេគុលកាន់តែខ្លាំង។ កម្លាំងប្រទាញកាន់តែខ្លាំង ចំណុចរលាយ ឬចំណុចរំពុះកាន់តែខ្ពស់។
ឧទា. `C_3H_8` មានចំណុចរំពុះខ្ពស់ជាង `CH_4`។ ទោះយ៉ាងណាក៏ដោយ កម្លាំងរបាយឡុនដុន មានលក្ខណៈខ្សោយជាងគេក្នុងចំណោមកម្លាំងអន្តរម៉ូលេគុលទាំងអស់។ ដូចនេះ ជាទូទៅគេពិចារណាទៅលើកម្លាំងអន្តរកម្មមួយនេះតែក្នុងករណីម៉ូលេគុល មិនប៉ូលប៉ុណ្ណោះ។
ម៉ូលេគុលឌីប៉ូលជាម៉ូលេគុលដែលអាតូមក្នុងម៉ូលេគុលមានអេឡិចត្រូអវិជ្ជមានខុសគ្នា។
កម្លាំងឌីប៉ូល-ឌីប៉ូល កើតឡើងរវាងប៉ូលវិជ្ជមាននៃម៉ូលេគុលមួយ ជាមួយប៉ូលអវិជ្ជមានន ម៉ូលេគុលមួយទៀត ។
កាលណាម៉ូលេគុលកាន់តែប៉ូល កម្លាំងឌីប៉ូល-ឌីប៉ូលកាន់តែខ្លាំង ។
កាលណាកម្លាំងឌីប៉ូល-ឌីប៉ូលកាន់តែខ្លាំង នោះចំណុចរលាយនិងចំណុច រំពុះនៃសមាសធាតុ នោះកាន់តែខ្ពស់។
កម្លាំងឌីប៉ូល-ឌីប៉ូល ធំជាងកម្លាំងរបាយឡុនដុន។ គេអាចហៅ កម្លាំងរបាយឡុនដុន ថាជាកម្លាំង ឌីប៉ូលអន្ទង។
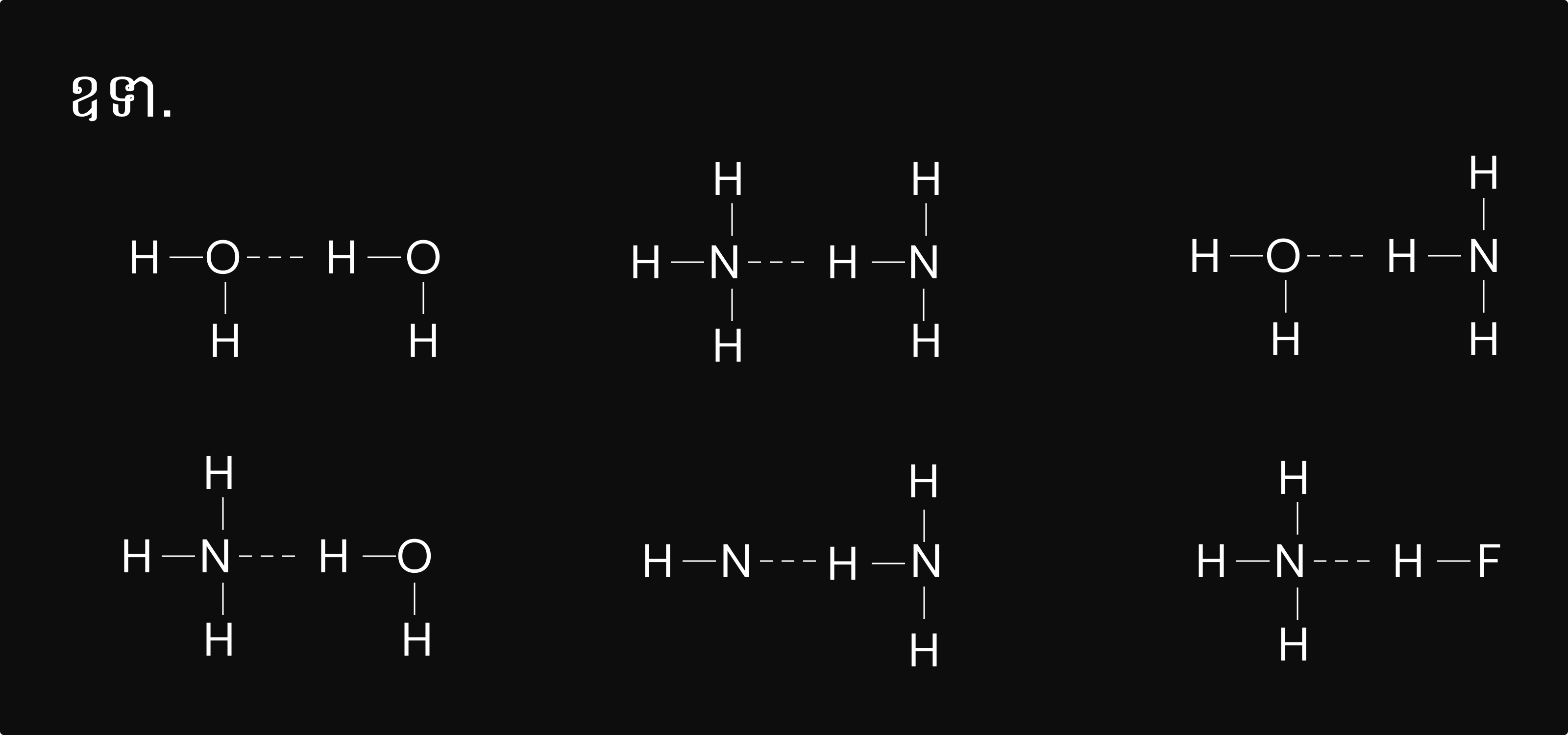
ជាកម្លាំងអន្តរម៉ូលេគុលកើតឡើងរវាងអាតូមអ៊ីដ្រូសែនក្នុងម៉ូលេគុលមួយ ជាមួយអាតូម មួយ ក្នុងម៉ូលេគុលមួយផ្សេងទៀតដែលមានកម្រិតអេឡិចត្រូអវិជ្ជមានធំ(មានធាតុ `N, O, `និង `F`)។ កម្លាំង អន្តរកម្មនេះ សរសេរជា៖ `A-H…B` ឬ `A-H…A`(`A`និងអាចជា `N, O, `ឬ `F`)។
លំហាត់គំរូ
ចូរកំណត់កម្លាំងអន្តរម៉ូលេគុលនិងសម្ព័ន្ធអ៊ីដ្រូសែ នៃគូក្នុងសមាសធាតុខាងក្រោម៖
ក) `HBr` និង `H_2S` ខ) `Cl_2` និង `CBr_4` គ) `NH_3`និង `H_2 0`
ចម្លើយ
ក) `HBr` និង `H_2S` ជាម៉ូលេគុលប៉ូល។ ដូចនេះ កម្លាំងរវាងម៉ូលេគុលទាំងពីរជាកម្លាំង ឌីប៉ូល-ឌីប៉ូលហើយវាក៏មានកម្លាំងឡុនដុនផងដែរ។
ខ) `Cl_2` និង `CBr_4`ជាម៉ូលេគុលមិនប៉ូល។ ដូចនេះ កម្លាំងរវាងម៉ូលេគុលទាំងពីរជា កម្លាំងឡុនដុនតែមួយគត់។
គ) `NH_3`និង `H_2 0` ជាម៉ូលេគុលប៉ូល។ ដូចនេះ កម្លាំងរវាងម៉ូលេគុលទាំងពីរជាកម្លាំង ឌីប៉ូល-ឌីប៉ូល។ ហើយវាក៏មានសម្ព័ន្ធអុីដ្រុសែនផងដែរ។
អាស៊ីត គឺជាសមាសធាតុទាំងឡាយណា ដែលមានលក្ខណៈដូចជា៖ មានរសជាតិ ជូរ កាត់ ឬស៊ី និងមាន pH < 7 ។ អាស៊ីតជាអេឡិចត្រូលីត និងអាចប្រែព៌ណអង្គធាតុចង្អុល ពណ៍។ អាស៊ីតមានប្រតិកម្ម ជាមួយបាសឲ្យ ផលជាអំបិលនិងទឹក ។
ឧទា. `HCl + NaOH → NaCl + H_2O`
អុីដ្រូអាស៊ីត ជាអាស៊ីតដែលផ្សំដោយ `H` និងធាតុមួយផ្សេងទៀតដែលមានកម្រិត អេឡិច ត្រអវិជ្ជមានខ្លាំង។
ឧទា. `HF` (អាស៊ីតភ្លុយអរីឌ្រិច) `HCl` (អាស៊ីតក្លរីឌ្រិច) `H_2S` (អាស៊ីតស៊ុលភីឌ្រិច)។
អុកស៊ីអាស៊ីត ជាអាស៊ីតដែលមានធាតុផ្សំ អុីដ្រូសែន `(H)` អុកស៊ីសែន `(O)` និងធាតុ ទី៣ដែល ភាគច្រើនជាអលោហៈ ។
ឧទា. `HNO`, អាស៊ីតនីឌ្រិច `H_2SO_4` អាស៊ីតស៊ុលផួរិច។
អាស៊ីតបំបែកជាអុីយ៉ុងអុីដ្រូញ៉ូម (H_2O^+ក្នុងទឹក)
`HCl (g) + H_2O (l) → Cl^- (aq) + H_3 0^+(aq)`
`HF (g) + H_2O (l) → F^- (aq) + H_3 0^+ (aq)`
អាស៊ីត ជាសារធាតុគីមីសំខាន់ណាស់ក្នុងមន្ទីរពិសោធន៍ និងក្នុងឧស្សាហកម្ម ដូចជា៖
អាស៊ីតស៊ុលផួរិច `H_2 SO_4`: ប្រើក្នុងឧស្សហកម្មផលិតលោហៈ ប្រេង ក្រដាស ល័ក្ខ សាប៊ូ...
អាស៊ីតនីទ្រិច `HNO_4` : ប្រើក្នុងឧស្សហកម្មផលិតប្លាស្ទិច ល័ក្ខ ឱសថ ជីគីមី គ្រឿងផ្ទុះ...
អាស៊ីតផូស្វរិច `H_3PSO_4` : ប្រើក្នុងឧស្សហកម្មផលិតជីគីមី ចំណីសត្វ សាប៊ូ
អាស៊ីតក្លរីឌ្រិច `HCl` : ក្នុងក្រពះ បន្សុទ្ធលោហៈ ភ្នាក់ងារសម្អាត ផលិតធាតុគីមី...
អាស៊ីតអាសេទិច `CH_3COOH` : ប្រើក្នុងឧស្សហកម្មផលិតប្លាស្ទិច ទឹកខ្មេះ អាហារ...
លំហាត់គំរូ
ក- ចូរសរសេរសមីការតាងប្រតិកម្មរវាងអាស៊ីត `H_2 SO_4` និង `H_3PSO_4` ជាមួយ `Ca(OH)`_2` ។
ខ- គេមានសមាសធាតុអាស៊ីតបន្តបន្ទាប់នេះ `H_3PSO_4`, `HClO_4 `, `HBr` និង `HI`។ ចូរកំណត់ អាស៊ីតទាំងនេះជាអុីដ្រូអាស៊ីត និងអុកស៊ីអាស៊ីតព្រមទាំងសរសេរសមីការអាស៊ីត `HBr` និង `HI` បំបែកជាអុីយ៉ុង អុីដ្រូញ៉ូម `(H_3O^+ )`ក្នុងទឹក ។
ចម្លើយ
ក- សរសេសមីការតាងប្រតិកម្ម
` H_2 SO_4 (aq)+ Ca(OH)_4 (aq) → CaSO_4 (aq) + H_2O (l)`
`2H_3 PO_4(aq) +3Ca(OH)_2 (aq) → Ca_3 (PO_4)_2 (aq) + 3H_2O(l)`
ខ- អុីដ្រូអាស៊ីតមាន `HBr` និង `HI`
អុកស៊ីអាស៊ីតមាន `H_2 P0`, និង `HCl0`, សមីការបំបែកដោយទឹកនអាស៊ីត
`HBr (g) + H_2O (l) → Br^- (aq) + H_3O^+ (aq)`
`HI (g) + H_2O (l) → I^- (aq) + H_3O^+ (aq)`
បាស គឺជាសមាសធាតុដែលមានលក្ខណៈដូចជា រសជាតិល្វីង កាត់ ឬស៊ី និងមាន pH>7 ។ បាសជា អេឡិចត្រូលីត និងអាចប្រែពណ៍អង្គធាតុចង្អុលពណ៍។ បាសមាន ប្រតិកម្មជាមួយអាស៊ីតឲ្យ ផលជាអំបិល និងទឹក ។
`KOH + HNO_3 → KNO_3 + H_2O`
បាសបំបែកជាអុីយ៉ុងអុីដ្រូកស៊ីត `(OH^-)` ក្នុងទឹក
`NaOH(s) → Na^+ (aq) + OH^ ̄ (aq)`
`NH_2 (g) + H_2O (l) → NH_4^+ (aq) + OH^- (aq)`
បាស ជាសារធាតុគីមីសំខាន់ក្នុងមន្ទីរពិសោធន៍ និងក្នុងឧស្សាហកម្ម ដូចជា៖
សូដ្យូមអុីដ្រូកស៊ីត ` (NaOH)` ត្រូវបានប្រើសម្រាប់ផលិតសាប៊ូ ក្រដាស និងសំយោគសារធាតុសរសៃដែលជារ៉ាយ៉ុង (rayon)។
កាល់ស្យូមអុីដ្រូកស៊ីត `(Ca(OH)_2)`ត្រូវបានប្រើសម្រាប់ផលិតម្មសៅនៃសារធាតុបន្ស។
លំហាត់គំរូ
ចូរសរសេរសមីការតាងប្រតិកម្មរវាងអាស៊ីត `KOH` និង`Ca(OH)_2 `ជាមួយ `H_2SO_4` ។
ចម្លើយ
`2KOH(aq) + H_2SO_2(aq) → K2SO_4(aq) + 2H_2O (l)`
`Ca(OH)_2(aq) + H_2SO_2(aq) → CaSO_2(aq) + 2H_2O (1)`
អាស៊ីត ជាសមាសធាតុគីមីដែលបង្កើតអ៊ីយ៉ុងអ៊ីដ្រូសែន `(H^+) `ក្នុងសូលុយស្យុងទឹក ។
ឧទា. `HCl (g) → H^+(aq) + Cl^- (aq)`
បាស ជាសមាសធាតុគីមីដែលបង្កើតអុីយ៉ុងអុីដ្រូកស៊ីត`( OH^-)`ក្នុងសូលុយស្យុងទឹក ។
ឧទា. `NaOH(s) → Na^+ (aq) + OH^- (aq)`
សូលុយស្យុងអាស៊ីត ជាអេឡិចត្រូលីតដែលមានអុីយ៉ុង `H^+` ច្រើនជាងអុីយ៉ុង `OH^-` ។ ក្នុងសូលុយស្យុងទឹកអីយ៉ុង`H^+`(ឬប្រូតុង)ចងសម្ព័ន្ធជាមួយម៉ូលេគុលទឹកបង្កើតជាអុីយ៉ុង`H_3O^+` ។
`H^+(aq) +H_2O (l) →H_2 O^+ (aq)`
ដូច្នេះ អុីយ៉ុងកម្មរបស់អាស៊ីតក្នុងទឹកគេអាចសរសេរ៖
`HCl(g) + H_2O(l) → Cl^- (aq) + H_2O^+ (aq)`
`HNO_3 (1) + H_2O(l) → NO_3^-(aq) + H_3O^+ (aq)`
សូលុយស្យុងបាស ជាអេឡិចត្រូលីតដែលមានអុីយ៉ុង `OH^-` ច្រើនជាងអុីយ៉ុង `H_3O^+`។
ឧទា. `NaOH(s) → Na^+ (aq) + OH^- (aq)`
`NH_3 (g) +H_4O (l) ⇌ NH_4^+ (aq) + 0H^- (aq)`
លំហាត់គំរូ
ចូរជ្រើសរើសសមាសធាតុខាងក្រោមនេះ `NH_3 , H_3 SO_4 , HCl, NaOH` និង `HNO_3` ជាអាស៊ីត និងបាសអារ៉ញ៉ូស។
ចម្លើយ
អាស៊ីតអារ៉ញ៉ូស៖ `H_3 SO_4 ,HNO_3 , `និង`HCl`
បាសអារ៉ញ៉ូស៖ `NH_3` និង `NaOH`
អាស៊ីត គឺជាប្រភេទគីមីទាំងឡាយណាដែលបោះបង់ប្រូតុង `(H^+)` ។
`HCl (g) + NH_3(g) → NH_4^+ (aq) + Cl^-(aq)`
`HCl` ជាអាស៊ីត ព្រោះវាបោះបង់ប្រូតុងឱ្យ `NH_3។`
បាស គឺជាប្រភេទគីមីទាំងឡាយណាដែលទទួលយកប្រូតុង ។
`NH_3 (g) + H_2O (l) → NH_4^+(aq) + OH_4^- (aq)`
`NH_3` ជាបាស ព្រោះវាទទួលប្រូតុងពី `H_20` ។
លំហាត់គំរូ
ចូរកំណត់ប្រភេទគីមីទាំងនេះ `NH_3, HCl, NH_4^+, HBr, NaOH` និង `H_2SO_4,` ជាអាស៊ីត ឬបាសប្រុងស្នៀត-ឡូរី។
ចម្លើយ
អាស៊ីតប្រុងស្ពត-ឡូរី `HCl, HBr, NH_4^+ `និង `H_2SO_4`
បាសប្រុងណ្តែត-ឡូរី `NH_4, NaOH`
អាស៊ីត គឺជាប្រភេទគីមីទាំងឡាយណាដែលទទួលទ្វេតាអេឡិចត្រុង ដើម្បីបង្កើតសម្ព័ន្ធធកូវ៉ាឡង់ ។

បាស គឺជាប្រភេទគីមីទាំងឡាយណាដែលឲ្យទ្វេតាអេឡិចត្រុង ដើម្បីបង្កើតសម្ព័ន្ធកូវ៉ាឡង់ ។
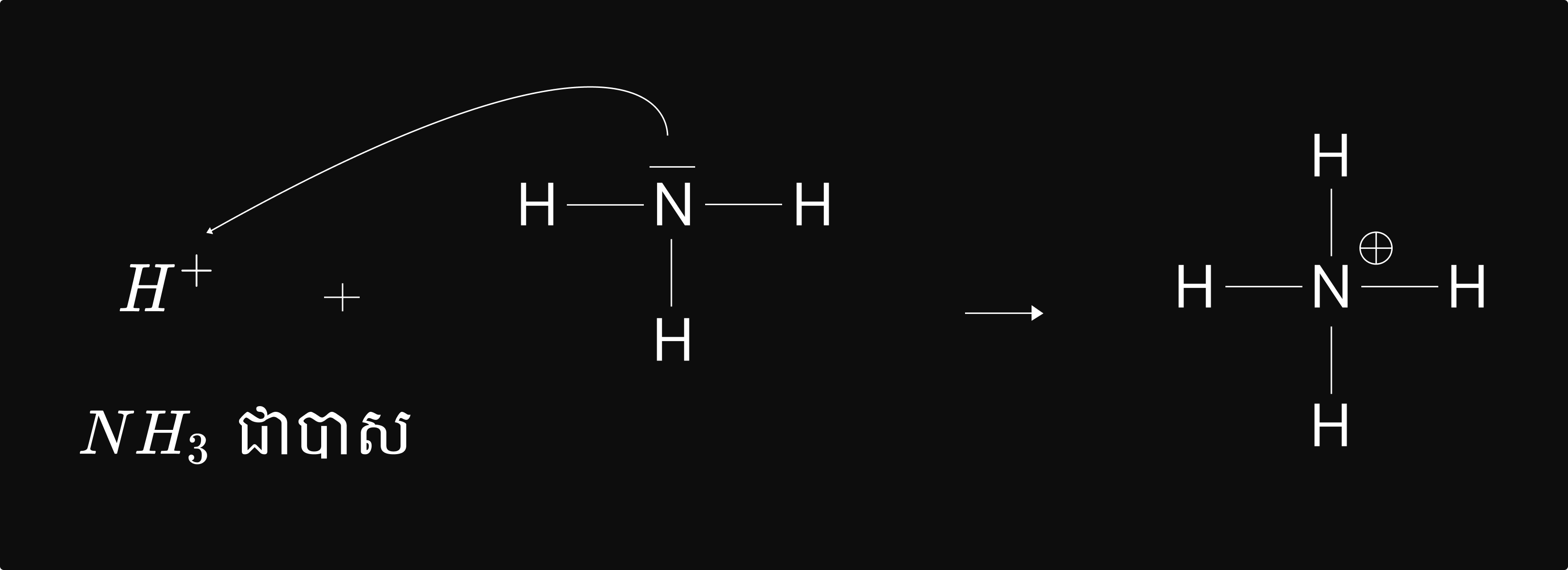
ឧទាហរណ៍ ៖ `H^+ (aq) + NH_3(aq) → NH_4^+ (aq)`
ម៉ូណូបទិចអាស៊ីត ជាអាស៊ីតដែលឲ្យប្រូតុងតែមួយក្នុងមួយម៉ូលេគុល ។
`HCl (aq) + H_2 O (l) → Cl^- (aq) + H_3O^+ (aq)`
` HNO_3 (aq) + H_2O (l) → NO_3^- (aq) + H_3O^+ (aq)`
ឌីប្រូទិចអាស៊ីត ជាអាស៊ីតដែលឲ្យប្រូតុងពីរក្នុងមួយម៉ូលេគុល ។
`2. H_2SO_4 (aq) + H_2O (l) → H_2SO_4^- (aq) + H_3O^+ (aq)`
`HSO_4^- (aq) + H_2O (l) → SO_3^(2-) (aq) + H_3O^+ (aq)`
ទ្រីប្រូទិចអាស៊ីត អាស៊ីតដែលឲ្យប្រូតុងបីក្នុងមួយម៉ូលេគុល ។
`2. H_3PO_4(aq) + H_2O (l) → H_2PO_4^- (aq) + H_3O^+ (aq)`
`H_2PO_4^- (aq) + H_2O (l) → HPO_4^(2-) (aq) + H_3O^+( aq)`
`HPO_4^(2-)(aq) + H_2O (l) → HPO_4^(3-) (aq) + H_3O^+ (aq)`
ក កម្លាំងអាសុីត និងបាស
ក. កម្លាំងអាសុីត
អាស៊ីតខ្លាំង ជាអាស៊ីតដែលបំបែកជាអុីយ៉ុងអុីដ្រូញ៉ូម `(H_2O^+)` មិនសព្វក្នុងទឹក ។
`ឧទា. HCl (ag) + H_2O (l) → Cl^- (aq) + H_2O^+ (aq)`
` HNO_3(ag) + H_2O (l) → NO_3^- (aq) +H_3O^+ (aq)`
` HClO_4(ag)+ H_2O (l) → ClO_4^- (aq) + H_3O^+ (aq)`
` H_2SO_4(aq) + 2H_2O (l) → SO_4^(2-) (aq) + 2H_2O^+ (aq)`
អាសុីតខ្សោយ ជាអាសុីតដែលបំបែកជាអុីដ្រូញ៉ួម `(H_3O^+)`មិនសព្វក្នុងទឹក។
`HF(ag) + H_2O(I ) ⇆ F^- (ag) + H_3O^+ (ag)`
`HCN(ag) + H_2O(I) ⇆ CN^- (ag) + H_3O^+ (ag)`
`CH_2COOH (ag) + H_3O (I) ⇆ CH_3COO^- (ag) H_3O^+ (ag)`
ខ. កម្លាំងបាស
បាសខ្លាំង ជាបាសដែលបំបែកជាអ៊ីយ៉ុងអ៊ីដ្រូងស៊ីត `(OH^-) `សព្វក្នុងទឹក ។
`KOH (s) to K^+ (ag) + OH^- (ag)`
`NaOH (s) to Na^+ (ag) + OH^- (ag)`
បាសខ្សោយ ជាបាសដែលបំបែកជាអ៊ីយ៉ុងអ៊ីដ្រូកស៊ីត `(OH)` មិនសព្វក្នុងទឹក ។
`NH_3(g) + H_2O (I) ⇆ NH_4^+ (ag) + OH^- (ag)`
`C_6H_5NH_2 (ag) + H_2O (I) ⇆ C_6H_5NH_3^+ (ag) + OH^- ( ag) `
`CH_3COO^- (ag) + H_2O (I) ⇆ CH_3COOH(ag)+ OH^- (ag) `
លំហាត់គំរូ
ចូរចាត់ថ្នាក់ប្រភេទគីមីបន្តបន្ទាប់នេះ `HCl, NaOH, NH_3 ,HC2H3O2 , HNO_3 , C_6H_5NH_2 , NaC_2H_5O_2` និង `HClO_4`, ជាអាស៊ីតខ្លាំង អាស៊ីតខ្សោយ បាសខ្លាំង និងបាសខ្សោយ។
ចម្លើយ
អាស៊ីតខ្លាំង: `HCl, HNO_3 , HClO_4`
អាស៊ីតខ្លាំងខ្សោយ : `HC_2H_3O_2`
បាសខ្សោយខ្លាំង : `NaOH`
បាសខ្សោយ: `HNO_3C_6H_5NH_2`
ក.អាស៊ីត
`HCOOH + H_2O ⇄ HCOO^- + H_3`
`CH_3COOH + H_2O ⇄ CH_3COO^- + H_3O^+`
`C_6H_5COOH + H_2O ⇄ C_6H_5COO^- + H_3O^+`
អាស៊ីតឆ្លាស់ បាសឆ្លាស់
ដូចនេះ បាសឆ្លាស់ គឺជាប្រភេទគីមីដែលនៅសល់ក្រោយពីអាស៊ីតប្រុងស្ទែត-ឡូរីបោះបង់ ប្រូតុង១ ។
ខ.បាស
`HCOO^- + H_2O ⇄ HCOOH + OH^- `
`CH_3COO- + H_2O ⇄ CH_3COOH + OH^- `
` C_6H_5COO^- + H_2O ⇄ C_6H_5COOH + OH^-`
២ អាស៊ីតឆ្លាស់
ដូចនេះ អាស៊ីតឆ្លាស់ គឺជាប្រភេទគីមីដែលកើតឡើងពេលដែលបាសប្រុងស្ទែត-ឡូរីចាប់ យកប្រតុង១។
លំហាត់គំរូ៖
ក. ចូរផ្តល់បាសឆ្លាស់របស់អាស៊ីតបន្តបន្ទាប់នេះ `CH_2ClCOOH , HIO_4, H_3PO_4 , NH_4^+ ,H_2S` ។
ខ. ចូរផ្តល់អាស៊ីតឆ្លាស់របស់បាសបន្តបន្ទាប់នេះ `HIO_4, , HSO,, NO, CH_3CH_2 C0O^- `/
ចម្លើយ
ក. បាសឆ្លាស់របស់អាស៊ីត `CH_2ClCOOH` គឺ `CH_2 ClCOO^- , HIO_4`, គឺ `IO_4^-, H_3PO_4 NH_4^+ `គឺ ` NH_4 S` គឺ `HS^-`
ខ. អាស៊ីតឆ្លាស់របស់បាស `NH_3` , គឺ `NH_4^+ , HSO_4^-` , គឺ `H_3SO_4NO_2^- `គឺ `HNO_2^-` និង `CH_3CH_2COO^-` គឺ `CH_3CH_2COOH`
គូអាស៊ីត-បាស គឺជាគូនៃប្រភេទគីមីឆ្លាស់គ្នាដែលប្តូរប្រូតុងគ្នាទៅមក។ គូអាស៊ីត-បាសគេសរសេរ អាស៊ីត/បាស។
ឧទា. `NH_3 (aq) + HF (aq) ⇄ NH_4 ^+ (aq) + F^- (aq)`
គេបានគូអាស៊ីត-បាស ២ គូ គឺ `NH4^+` / ` NH_3`និង `HF` / `F`
លំហាត់គំរូ
ចូរកំណត់គូអាស៊ីតបាសនៃប្រតិកម្មនីមួយៗខាងក្រោមនេះ៖
a) `CH_3ClCOO^- + HCN ⇄ CH_3ClCOOH + CN^- `
b) `HClO + CH_3NH_2 ⇄ CH_3NH_3^+ + ClO^-`
c) `CH_3CH_2COO^- + H_2O ⇄ CH_3CH_2COOH + OH^-`
ចម្លើយ
a) គូអាស៊ីត-បាស ២ គូ គឺ `CH_3CHCOOH ` / `CH3COOH ` និង `HCN` / `CN^-`
b) គូអាស៊ីត-បាស ២ គូ គឺ `HClO` / ` ClO^-` និង `CH_3NH_3^+ `/ `CH_3NH_2`
c) គូអាស៊ីត-បាស ២ គូ គឺ `CH_3CH_2COOH` / `CH_3CH_2COO^-` និង `H_2O `/ `OH^-`
- អាស៊ីតខ្លាំង បាសខ្លាំង៖ `HCl (aq) + NaOH (aq) → NaCl (aq) + H_2O (I)` ល្បាយក្រោយប្រតិកម្មជាសូលុយស្យុងណឺត។
- អាស៊ីតខ្លាំង បាសខ្សោយ៖ `HCl(aq) + CH_3COONa(aq) → NaCl (aq) +CH_3COOH (aq)` ល្បាយក្រោយប្រតិកម្មជាសូលុយស្យុងអាស៊ីតខ្សោយ។
- អាស៊ីតខ្សោយ បាសខ្លាំង៖ `CH_3COOH (aq) + NaOH(aq) → CH_2COONa(aq) + H_2O (I) `ល្បាយក្រោយប្រតិកម្មជាសូលុយស្យុងបាសខ្សោយ។ ចំណាំ៖ ប្រតិកម្មទាំងបីប្រភេទខាងលើជាប្រតិកម្មសព្វ។
ម៉ូលេគុលទឹកមួយបោះបង់ប្រូតុងឲ្យទឹកមួយទៀត ហៅថា ស្វ័យអីយ៉ុងកម្មនៃទឹក ឬ អូតូប្រូតូលីសនៃទឹក។
`H_2O (l) + H_2O (l) ⇆ H_2O^+ (aq) + OH^- (aq)`
នៅសីតុណ្ហភាព `25°C` ទឹកសុទ្ធមាន ` pH =7` និងមានកំហាប់ `[ H_2O^+] = [ 0H^- ] = 10^(-7)mol.L^(-7)`
ផលគុណរវាងកំហាប់អុីយ៉ុង `H_3O^+` និង `OH^-` ហៅថាផលគុណអុីយ៉ុងនៃទឹក `(Ke` ឬ `Kw)`។
`[H_3O^+] times [ OH^-] = Ke `ផលគុណនេះមានតម្លៃថេរជានិច្ច (ជាទំហំគ្មានខ្នាត ប្រែប្រួលតាមសីតុណ្ហភាព) ។
នៅសីតុណ្ហភាព 25°C ទឹកសុទ្ធមាន ` Ke = [ H_3O^+ ] times [ OH^- ]` = 10^(-14)
មជ្ឈដ្ឋានសូលុយស្យុងមានបីគឺ
`[ H_3O^+ ] = [ OH^- ]` ជាសូលុយស្យុងណឺត `( pH = 7)`
`[ H_3O^+ ] > [ OH^- ]` ជាសូលុយស្យុងអាស៊ីត `( pH < 7)`
`[ H_3O^+ ] < [ OH^- ]` ជាសូលុយស្យុងបាស `( pH> 7)`
តម្លៃ Ke របស់ទឹកប្រែប្រួលតាមសីតុណ្ហភាព
| សីតុ `(°C )` | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 100 |
| ` K_e(10^(-14)) ` | 0.114 | 0.293 | 0.681 | 0.1008 | 1.471 | 2.916 | 5.476 | 51.3 |
និយមន័យ `pH` ៖
`pH` នៃសូលុយស្យុងរាវ ជាទំហំផ្ទុយនឹងឡូការីតគោលដប់នៃកំហាប់អុីយ៉ុងអុីដ្រូញ៉ូម `[ H_3O^+ ]` របស់សូលុយស្យុងនោះ ។
`pH = - Log [ H_3O^+] ↔ [ H_3O^++ ] = 10^(-pH)`
`pO`H នៃសូលុយស្យុងរាវ ជាទំហំផ្ទុយនឹងឡូការីតគោលដប់នៃកំហាប់អុីយ៉ុងអុីដ្រូកស៊ីត `[OH^-]` របស់សូលុយស្យុងនោះ ។
`pOH = -log [ OH^- ] \Leftrightarrow [ OH- ] = 10-pOH`
នៅសីតុណ្ហភាព 25°C ទឹកសុទ្ធមាន `K_w= 10^(-14) pK_w = - logK_w = - log 10^(-14)=14
pH + pOH = 14`
សំគាល់ សូលុយស្យុងផាតនៅគ្រប់សីតុណ្ហភាពមាន `[ H_3O^+ ] = [ 0H^- ]`
រង្វាស់ pH
- កំណត់ `pH` ដោយប្រើក្រដាស `pH` ឬប្រើឧបករណ៍ `pH` ម៉ែត្រ ។
លំហាត់គំរូ
១. ចូរកំណត់ pH នៃអូតូប្រូតូលីសរបស់ទឹកនៅសីតុណ្ហភាព 30°C
២. សូលុយស្យុងមួយមាន pH =7.52 ។ គណនា
ក. កំហាប់អុីយ៉ុងអុីដ្រូញ៉ូម
ខ. កំហាប់អុីយ៉ុងអុីដ្រូកស៊ីត
គ. តើវាជាសូលុយស្យុងអាស៊ីត ឬ សូលុយស្យុងបាស?